Biosens Bioelectron:离子印迹策略合成的新型二合一铜基纳米酶用于灵敏电化学/比色双模检测扑热息痛
- 2025-07-22 07:34:46

点击蓝字 关注我们

英文标题:Ion-imprinting strategy towards a novel two-in-one copper-based nanozyme for sensitive electrochemical-colorimetric dual-mode detection of paracetamol

成果简介
扑热息痛(Paracetamol, PA)是全球市场上最畅销的解热镇痛药,然而,人体对50 mg L−1的PA表现出耐药性,长期或过量使用PA可导致毒性代谢物的蓄积,最终导致肾脏和肝脏损伤。巨大的消耗量可能导致PA大量暴露于生活和医疗废水中,并且其代谢物之一N-乙酰基-对苯醌亚胺对水生生物具有毒性。因此,亟需开发快速、简便和精准的PA检测工具以实现安全用药和环境保护。
传统单模式或单信号检测受到仪器效率、操作程序和测定条件的影响易出现不准确的分析结果或假阳性反应。因此采取双位点识别和双模式信号读出策略能有效提高传感器的特异性并赋予其自校准能力。其中电化学/比色双模式检测方法可以通过集成复杂的电化学传感机制来增强灵敏度、选择性和实用性。
原子簇(AC)的尺寸以及金属单原子(SA)的局部配位显著影响反应活性。金属SA作为许多催化反应的活性位点已被广泛认可,而表面具有高比例的金属原子、丰富的催化反应活性位点的金属AC是连接金属SA和大尺寸金属纳米颗粒的桥梁。有报道证明同时含有SA和AC的催化剂具有优越的催化活性。然而,SAs/ACs纳米酶的可控合成仍然相当困难。离子印迹技术是指在模板金属离子的存在下交联功能性单体以获得聚合物的技术,将其引入到SAs/ACs材料合成中的主要优点是:(1)聚合物中的模板金属离子即使在高温下也无法轻易迁移,从而有效地增强了金属原子负载,同时使不希望的金属聚集最小化;(2)化学可调的印迹环境可以精确地调节金属中心的配位环境;(3)催化剂合成简单,没有复杂的处理步骤。
本研究采取串联离子印迹-热解-蚀刻策略,将Cu SAs和ACs固定在壳聚糖衍生的碳载体上(CuSAs/ACs@NC nanozyme)。在CuSAs/ACs@NC的合成过程中,Cu2+在聚合物前体空腔中的限制和紧密结合确保了在高温热解过程中同步产生SAs/ACs活性位点,形成CuSAs/ACs@NC。此外,通过改变离子印迹过程中使用的Cu2+浓度,还制备了在N掺杂的壳聚糖衍生的碳载体上仅含有SAs(CuSAs@NC)和两种粒径的Cu NPs(CuNPs-1@NC和CuNPs-2@NC)的对照催化剂。与CuSAs@NC、CuNPs-1@NC和CuNPs-2@NC相比,CuSAs/ACs@NC具有更低的米氏常数(Km)和更高的电化学响应,其酶促和电催化性能的增强源于SAs和ACs之间的协同效应。作为概念验证,CuSAs/ACs@NC成功地应用于PA的双模式电化学和比色传感系统,线性范围分别为2.00-473.00 μM和0.25-100.00 μM。双重信号转换和独立信号读出功能可实现市售PA制剂中准确可靠的PA检测,为药品质量监测和临床诊断提供了一个简单、快速、可靠的双模传感器工具。
研究亮点
材料合成创新:
(1)离子印迹-热解-刻蚀策略:采用串联离子印迹-热解-刻蚀策略制备CuSAs/ACs@NC纳米酶。通过离子印迹技术将模板金属离子固定在聚合物前驱体的空腔中,在高温热解过程中同步形成SAs/ACs活性位点;
(2)显著协同效应:CuSAs和ACs之间存在协同作用,增强了电子传输,提高了纳米酶的电催化活性和类过氧化物酶活性。与仅含SAs或Cu NPs的纳米酶相比,CuSAs/ACs@NC纳米酶表现出更低的米氏常数(Km)和更高的电化学响应。
电化学-比色双模式传感:
(1)分别基于PA的电化学信号放大和PA对过氧化物酶活性的抑制作用,实现了对PA的电化学/比色双模式检测,在商业药物检测中相对偏差低于1.5%;
(2)电化学模式的线性范围为2.00 - 473.00 μM,检测限为0.48 μM;比色模式的线性范围为0.25 - 100.00 μM,检测限为0.10 μM,展现出较宽的检测范围和较高的灵敏度。
图文解析

图1. CuSAs/ACs@NC纳米酶的合成过程和PA的电化学/比色双模式传感机制示意图。
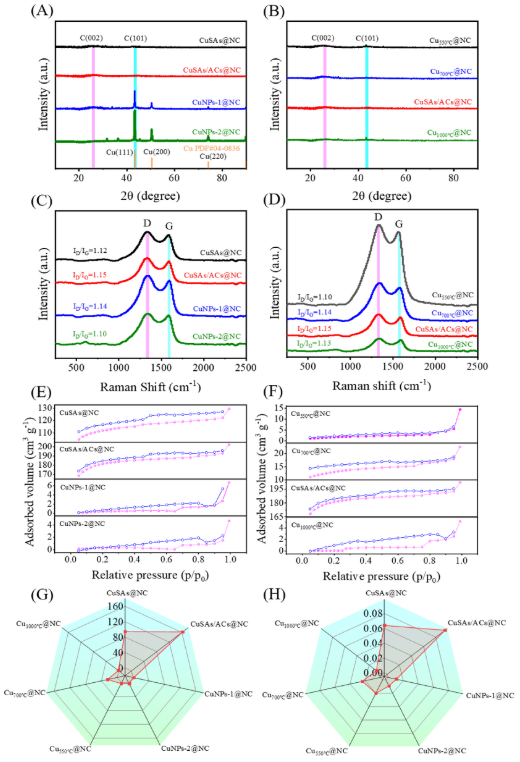
图2. CuSAs@NC、CuSAs/ACs@NC、CuNPs-1@NC、CuNPs-2@NC、Cu550℃@NC、Cu700℃@NC和Cu1000℃@NC的(A和B)XRD图谱、(C和D)拉曼光谱、(E和F)N2吸附-脱附等温线、(G)BET表面积和(H)孔体积图。

图3. (A)CuSAs@NC、(B)CuSAs/ACs@NC、(C)CuNPs-1@NC和(D)CuNPs-2@NC的SEM图像;CuSAs/ACs@NC的(E)TEM、(F)HRTEM、(G)AC-HAADF-STEM、(H)SAED和(I)EDS图谱;(J)CuSAs/ACs@NC、CuSAs@NC和CuNPs-2@NC的XPS全谱以及相应的(K)C 1s、(L)N 1s和(M)Cu 2p的XPS精细谱。
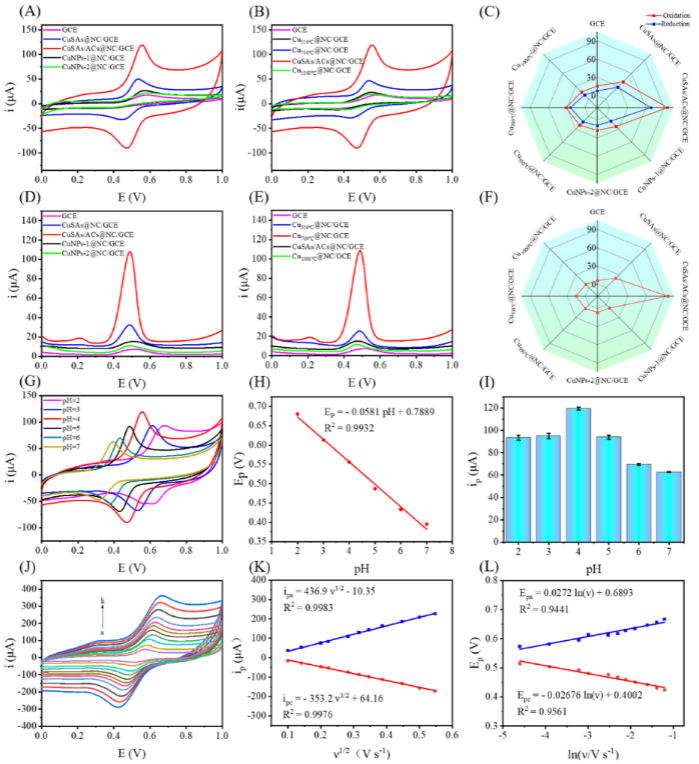
图4. 在1.0 mM PA溶液(pH 4.0)中以0.05 V s−1为扫描速率记录的不同修饰电极的(A和B)CV和(D和E)DPV曲线;所有修饰电极的(C)CV峰电流和(F)DPV峰电流的雷达图;(G)不同pH值的1.00 mM PA溶液中CuSAs/ACs@NC/GCE上的CV曲线(扫描速率:0.05 V s−1);(H)Epa与pH的线性关系图;(I)不同pH值下ip的直方图;(J)在不同扫描速率(a-k:0.01-0.30 V s−1)下,1.0 mM PA(pH 4.0)中的CuSAs/ACs@NC/GCE的CV曲线;(K)ipa(或ipc)与v1/2的线性关系图;(L)Epa(或Epc)与lnv之间的线性关系图。

图5. (A和C)在顺序添加不同量PA的乙酸盐缓冲液(pH 4.0)中的记录的所有修饰电极在0.6 V下的I-t曲线;(B和D)所有修饰电极的is与浓度的线性校准曲线(误差棒表示三次重复的标准偏差);(E、F和G)CuSAs/ACs@NC/GCE对PA以及潜在干扰物质的I-t响应;(H)CuSAs/ACs@NC/GCE在10000 s内对5.00 μM PA的I-t响应:(a)储存前和(b)储存4个月后;(I)使用(a)相同电极和(b)六个不同电极测量CuSAs/ACs@NC/GCE对5.00 μM PA的重复性和再现性。

图6. (A)各种反应体系的紫外-可见吸收光谱(插图:相应反应体系的照片);(B和C)具有不同催化剂的TMB-H2O2体系的紫外-可见吸收光谱(插图:相应体系的照片);(D)不同pH值下CuSAs/ACs@NC-TMB-H2O2体系的吸光度值;(E)不同清除剂对CuSAs/ACs@NC-TMB-H2O2体系在652 nm处的紫外-可见吸收强度的影响;(F)CuSAs/ACs@NC在H2O2存在下产生•OH与TA反应产生的二羟基对苯二甲酸的荧光光谱;分别在固定TMB浓度(1.00 mM)下改变H2O2浓度和在固定H2O2浓度(0.30 mM)下改变TMB浓度的CuSAs/ACs@NC的(G和I)UV-可见吸收光谱和(H和J)Michaelis-Menten曲线(插图:相应的Lineweaver-Burk图);(K)随着PA浓度的增加CuSAs/ACs@NC-TMB-H2O2体系的紫外-可见吸收光谱;(L)logΔA与logCPA的线性图。
研究结论
本研究采用离子印迹-热解-刻蚀的方法,设计并合成了一种新型的基于Cu SAs/ACs锚定在N掺杂壳聚糖衍生碳载体上的Cu基纳米酶体系(CuSAs/ACs@NC)。所制得CuSAs/ACs@NC纳米酶结合了CuSAs/ACs的协同催化作用和NC骨架的高比表面积,具有优异的电催化性能和类过氧化物酶催化活性,可用于构建电化学/比色双模式传感器。该双模式传感器成功应用于PA检测,电化学模式的线性范围为2.00-473.00 μM,检出限为0.48 μM;比色模式的线性范围为0.25-100.00 μM,检出限为0.10 μM。此外,该双模式传感器具有良好的重现性(相对标准偏差≤ 4.00%)、稳定性(储存4个月后保持稳定)和准确度(回收率为91.5- 114.9%)。值得注意的是,双模式传感器提供了可靠且无干扰的PA检测,且商业药物中双模式PA检测的偏差低于1.5%。这项工作为制备具有传感、药物监测和临床诊断功能的SAs/ACs纳米酶提供了一种新策略。
免责声明:原创仅代表原创编译,水平有限,仅供学术交流,如有侵权,请联系删除,文献解读如有疏漏之处,我们深表歉意。


公众号丨智能传感与脑机接口
 扫码添加微信
扫码添加微信
- 点赞 (0)
-
分享
微信扫一扫
-
加入群聊
 扫码加入群聊
扫码加入群聊













