文献速递 | 量化在三个人中慢性植入956-2246天的980个皮层内微电极的物理退化及其记录和刺激性能
- 2025-07-30 15:00:00
文献速递

作者:D.A.Bjånes, S.Kells, R.Nickl, B.Baker, T. Affalo, L.Bashford, S.Chivukula, M.S.Fifer, L.E. Osborn, B.Christie, B.A. Wester, P.A. Celnik, D. Kramer, K.Pejsa, N.E. Crone, W.S.Anderson, N. Pouratian, B.Lee, C.Y.Liu, F.Tenore, L.Rieth, R.A.Andersen
摘要
1. 动机
脑机接口(BMI)的临床成功取决于克服生物学和材料学挑战,以确保神经记录和刺激的长期稳定连接。因此,需要量化微电极在人类皮层中长期植入时所遭受的任何损伤。
2. 方法
我们使用扫描电子显微镜(SEM)对来自Neuroport阵列的980个微电极进行了成像,这些阵列在三名四肢瘫痪患者的皮层中慢性植入956-2246天。我们总共分析了十一个多电极阵列:八个带有铂(Pt)电极尖端的阵列和三个带有溅射氧化铱薄膜(SIROF)尖端的阵列;一个Pt阵列作为对照,保留在无菌包装中。这些阵列通过三个不同的临床中心手术(Caltech/UCLA、Caltech/USC和APL/Johns Hopkins)植入/取出,植入位置包括顶内沟前区、布罗德曼5区、运动皮层和体感皮层。
人类专家根据五个损伤指标对电极的电镜照片进行评级:电极尖端金属的损失量、硅针与尖端金属之间的分离量、组织粘附或生物材料附着于电极的情况、针绝缘层的损坏以及硅针杆的损坏。这些指标与功能结果(记录质量、噪声、阻抗和刺激能力)进行了比较。
3. 结果
尽管物理退化程度更高,但在取出时,SIROF电极记录到神经活动(通过SNR测量)的可能性是Pt电极的两倍。此外,1 kHz阻抗(在取出前体内测量)与SIROF电极的所有物理损伤指标、记录和刺激性能均显著相关(但Pt电极不相关),这表明阻抗是体内退化的可靠测量指标。
我们观察到一种新的退化类型,主要发生在被刺激的电极上(“麻点状” vs “裂纹状”);然而,尖端金属化损伤并未因刺激或电荷量而显著增加。物理损伤集中在阵列的特定区域,通常在边缘和内部电极之间存在差异。这与生物环境接触引起的降解一致,并受到初始制造状态变化的影响。根据我们的数据,我们假设硅针杆的侵蚀通常先于尖端金属的损伤,从而加速电极/组织界面的损坏。
4. 结论
这些发现将阻抗等定量测量与微电极的物理状况及其记录和刺激能力联系起来。随着多年期BMI临床试验日益普遍,这些数据可能有助于改进制造工艺或开发新型电极设计,以提高BMI的长期性能,使其至关重要。
引言
微电极阵列的长期记录和刺激稳定性是皮层内脑机接口(BMI)临床可行性的基本要求。此类 BMI 设备通过记录皮层神经活动,在治疗和功能恢复应用中展现出巨大前景。这些信号可以被处理以解码大量详细信息:运动规划和意图、高级认知目标、语音和语言以及失调的神经活动。此外,BMI 可以通过电刺激将信息写入皮层网络,创造新的体感感知和视觉刺激。
在人类和非人灵长类动物中均已研究了记录的皮层神经活动的纵向稳定性,表明信号可以从慢性植入的电极记录长达四年。然而,皮层内微电极(如 Neuroport “犹他” 阵列,Blackrock NeuroTech, Inc.)的纵向 BMI 性能在参与者之间差异很大,因为记录质量会随时间下降。在人类受试者和动物模型中长期植入犹他倾斜电极阵列期间也观察到了类似的趋势。生物因素(如炎症和电极部位周围的瘢痕组织包裹)以及非生物因素(如设备材料退化和电极相对于大脑的微动引起的机械故障)都是植入微电极的潜在退化机制。
对植入微电极阵列的生物反应包括胶质细胞活动和作为异物反应形成的胶质鞘包裹。这些组织反应会对电极性能产生不利影响。例如,一项关于植入犹他阵列七个月的参与者的案例研究揭示了组织损伤与记录性能下降相关。植入的电极也可能因脑膜组织向下生长而移位,在某些情况下,这导致了非人灵长类动物中近 30% 的慢性设备故障。植入时间延长与更严重的脑膜向下生长相关,增加了与功能神经元的距离并使电通路复杂化。
材料退化是另一个重大障碍。聚对二甲苯 - C(Parylene-C),一种常见的电极涂层材料,在生理条件下可能开裂。在先前的研究中,封装损伤与电极阻抗降低相关,并且可能取决于封装涂层下方的材料。所有报告 Neuroport 阵列纵向阻抗的研究都表明阻抗显著下降,渐近地趋近远低于植入初期的值。此外,硅在恶劣的体内环境中的溶解仍然是植入式硅基设备的一个关键问题。硅在体内降解的机制和动力学尚未完全确定,很可能取决于多种因素,如生物环境的组成、硅的掺杂和制造工艺。
电刺激对电极材料和周围组织的影响是 BMI 长期可行性的关键考虑因素。强烈的电刺激会侵蚀溅射氧化铱薄膜(SIROF)(另一种常见的电极涂层材料),导致功能丧失,尽管最近的研究结果表明 SIROF 的优化正在提高其在不退化的情况下可传递的电荷量。电极尖端的机械故障(可能由刺激引起的退化导致)是另一个常见问题,并且在一些对照电极上也观察到了。
为了评估神经植入物的寿命和性能,已采用多种技术来量化慢性植入电极的失效模式。研究人员利用扫描电子显微镜(SEM)评估了慢性植入阵列(Pt 约 1000 天,SIROF 约 200 天)的封装情况图像。这些初步结果显示,严重损坏电极尖端的普遍性与植入时间呈正相关,这与其他临床前研究一致。此外,研究人员注意到与刺激相关的不规则损伤,但未描述因果关系。Takmakov 等人采用了加速老化技术,使用活性氧在体外模拟长期降解,以建立已知的降解机制。此外,大量动物研究试图将电极性能与可测量的退化特性(如阻抗、已知的异物反应和生化反应)关联起来。简而言之,BMI 的临床可行性取决于克服生物学和材料学挑战,为神经记录和刺激提供长期稳定的接口。因此,本研究的目标是评估慢性植入的皮层内微电极的潜在损伤,并将观察到的损伤与植入物整个生命周期内收集的可测量数据相关联。
方法
由于常用术语存在重叠,我们为本文定义一些术语。电极将被定义为阵列上的单个针杆,由硅杆、绝缘层和尖端金属组成。电极部位是指通过去除聚对二甲苯-C(Parylene-C)绝缘层而暴露出的尖端金属化区域。针杆(Shank)指电极内的硅杆,对于FDA批准的阵列(K042384, K070272, K110010),其长度为1.0毫米或1.5毫米。阵列(Array)指网格中的一组电极,通常为10x10或6x10(图1C,D,F,G)。通道(Channel)指从阵列上单个电极收集的数据。组件(Assembly)由Neuroport基座(pedestal)组成,通过一根硅胶包裹金导线的引线(线束)连接一个或多个阵列。Blackrock NeuroTech, Inc.(美国犹他州盐湖城)制造了所有这些阵列和组件。公司产品文档将单个阵列和基座的组件称为NeuroPort阵列(图1E),将多个连接阵列到一个基座的组件称为MultiPort阵列。
表 1 | 电极时间线


图 1 | 设备和植入位置的SEM图像
使用扫描电子显微镜捕获每个阵列的物理损伤。
(A) 扫描电子显微镜图像在加州理工学院的Kavli纳米科学研究所和犹他大学纳米加工中心获取。
(B) 每个电极用碳带固定在“卡盘”上,线束接地。
(C) JHU/APL参与者铂尖端阵列(M1b)的整阵列图像,植入2.6年后取出。
(D) JHU/APL参与者溅射氧化铱薄膜(SIROF)尖端阵列(S1a)的整阵列图像,植入956天后取出。
(E) 制造商Blackrock Neurotech, Inc.提供的NeuroPort图像。未显示的是两根参考导线在植入时附着在阵列附近的基座上。
(F) 每种类型阵列的连接和未连接电极的通道布局,以及线束位置。
(G) 十个植入阵列的植入位置。完整的手术植入细节和程序可在其各自的出版物中找到。
1. 参与者
三名C5-C6级脊髓损伤的人类参与者知情同意并慢性植入了NeuroPort阵列。用于Caltech/USC研究中参与者的所有人体研究、实验设计和生物医学设备均获得了加州理工学院、南加州大学和Rancho Los Amigos国家康复医院机构审查委员会(IRB)的批准,用于在注册的临床试验(NCT01849822)中收集数据。对于Caltech/UCLA研究中的参与者,所有方案均获得了加州理工学院和加州大学洛杉矶分校(UCLA)机构审查委员会(IRB)的批准(NCT01958086)。对于JHU/APL参与者,该研究在FDA研究性器械豁免(IDE)下进行;获得了FDA、约翰霍普金斯机构审查委员会(JH IRB)和NIWC人类研究保护办公室的批准;并且是注册的临床试验(NCT03161067)。所有参与者在参与研究相关活动之前均给予了书面知情同意。
2. 设备
这项工作分析了十一个微电极阵列,这些阵列是Blackrock Neurotech制造的八个组件的一部分,总计980个电极。其中十个阵列在人类皮层中慢性植入956-2246天,一个未植入的阵列作为对照样品。分析了两种尖端金属类型:铂(Pt)和溅射氧化铱薄膜(SIROF)。四个Pt阵列采用10x10网格布局,96个电极连接到一个基座(图1F),植入在Caltech/USC 和Caltech/UCLA研究的参与者中。三个Multiport组件植入一名JHU/APL研究的参与者,每个组件包含一个10x10 Pt阵列(96个连接电极)和一个6x10 SIROF阵列(60个电极中的32个连接)组装到一个128通道的Neuroport™基座上(图1F,G)。在取出手术中,每个阵列通过切断引线与基座断开。一个Pt阵列(10x10)的制造时间与Caltech植入阵列相近,未植入并保存在原始无菌包装中,从制造商验证日期到SEM分析持续了1337天。该阵列被成像作为对照样品。这些组件构建起来费力耗时,因此使用制造商验证日期作为构建完成日期。
3. 植入
Caltech/USC的参与者有一个Pt阵列植入左侧顶内沟前区(AIP),一个Pt阵列植入左侧布罗德曼5区(BA5),植入时间为2246天。Caltech/UCLA的参与者有一个Pt阵列植入左侧AIP,一个Pt阵列植入左侧布罗德曼5区(BA5),植入时间为1988天。一名人类参与者在约翰霍普金斯大学植入了三个Multiport NeuroPort组件(每个组件包含一个Pt阵列和一个SIROF阵列,连接到一个基座),植入时间为956天。该参与者分别有两个Pt和两个SIROF阵列植入左侧初级运动和体感皮层(优势半球M1和S1),以及一个Pt和一个SIROF阵列分别植入右侧M1和S1。关于手术方法和阵列位置的完整细节(图1G)可在第一位和第二位Caltech参与者以及JHU/APL参与者的先前文章中找到。
4. 外植体程序
Caltech/USC、Caltech/UCLA和JHU/APL的团队分别取出了三组阵列。无法在所有情况下确定所评估设备的精确处理方式,但要么涉及用水冲洗和储存,要么使用酶清洁剂灭菌、冲洗和储存。如果进行了灭菌,取出的设备会浸泡在EnzoI™(Advanced Sterilization Products, Irvine, CA, USA)中,这是一种用于医疗器械灭菌的酶促去污剂。然后用纯水彻底冲洗,风干,并储存在密闭容器中。先前的工作已仔细评估了EnzoI对犹他阵列和聚对二甲苯薄膜的成分和化学性质的影响,未观察到变化。因此,预计这两种术后处理程序都不会影响本次检查的结果。取出的设备上没有粘附软组织,这表明酶清洁程序更可能用于所有阵列。
在Caltech/USC参与者(图1:阵列AIP(a)和BA5)的取出过程中,外科医生使用显微解剖器将导线与皮层和蛛网膜分离。他们从四周抬起每个阵列,将其从皮层中取出。在Caltech/UCLA研究的取出过程中,观察到两个阵列均被软组织包裹。移除设备后,下方组织留下了清晰的压痕,这在所有阵列位置都是常见的发现(图S5)。
在取出JHU/APL参与者的外科医生报告称,皮肤紧密地附着在每个基座的底部,并显示为健康的皮肤组织,无感染迹象。对侧开颅术中的阵列(M1a,b, S1a,b)被轻松取出,与皮层组织有轻微粘连。S1c未能完整取出,但M1c可以完整取出。下方的皮层组织看起来健康,带有一些纤维组织(图S5)。大多数电极阵列都有一些瘢痕包裹。
5. SEM表征
扫描电子显微镜图像在加州理工学院的Kavli纳米科学研究所(FEI Quanta 200, Thermofisher, Hillsborough, MI)和犹他大学纳米加工中心(FEI Quanta 600, Thermofisher, Hillsborough, MI)获取(图1A, 图S4)。980个电极中的每一个都在500x、1200x和2500x倍率下成像,同时采集背散射电子和二次电子信号,产生了近6000张图像。图像主要在20 kV初级束能量下,在高真空条件下使用极靴上的固态探测器获取背散射图像,使用Everhardt-Thornley探测器获取二次电子图像。使用10至20毫米的工作距离,以便在低倍率下对整个阵列成像,在高倍率下对单个电极成像。背散射成像提供了显著的Z对比度,极大地促进了硅、Pt或SIROF尖端金属化层、聚对二甲苯-C和硅胶材料的区分。所有图像均在无涂层条件下采集,以改善表面导电性,从而保持背散射成像对比度并避免表面形态的改变。当持续的充电干扰成像时,偶尔使用大视场探测器(LFD)在低真空条件下进行二次电子成像。通过这些方法对阵列进行表征,生成了一个包含近6000张图像的数据集。每个电极都用碳带固定在“卡盘”上,线束尽可能用碳带覆盖其切断端并接地(图1B)。
6. 纵向神经数据收集
在每个植入并连接的电极的整个生命周期中,定期使用Blackrock Cerebus神经信号处理器(NSP)记录阻抗数据和宽带电生理波形,以评估电极的功能和性能(图8)。所有10x10 Pt阵列的四个角上的电极连接到患者地线,SIROF阵列上的60个电极中有28个未电连接(图1F,G)。因此,没有从这些电极记录电生理数据,但它们通过SEM进行了成像。
阻抗幅值使用Blackrock Cerebus和患者导线的阻抗测量功能进行测量。测量使用1kHz正弦波,峰峰值为10 nA,持续1秒,并记录电极上的结果电压。该系统无法测量<30 kΩ的阻抗,并且在低阻抗范围内的精度会下降。这可能会影响准确测量低阻抗SIROF电极的能力,特别是在阻抗显著降低的长期留置期间。
宽带电生理波形以30 kHz采样率数字化,并在0.3 - 15 kHz之间进行硬件带通滤波。对宽带信号应用软件带通滤波器(0.25 - 5 kHz)以评估每个电极记录周围神经元单个动作电位的能力。基线噪声在植入物寿命期间通过软件滤波信号的估计均方根(RMS)进行纵向测量(图8D)。
7. 研究结束时的电极功能指标
六位专家系统地观察了电极的电镜照片,针对五个损伤指标进行评分,分数为1、2、3或4,从无损伤(1)到严重损伤(4)(表2,图2A)。所有专家的评分针对每个指标取平均值。金属化(Metallization)量化了电极尖端金属的损失量(图S3)。分离(Separation)评估了硅针杆和尖端金属之间的分离量。正常情况下,作为设备制造的一部分,金属应与硅针杆直接接触。绝缘(Insulation)评估了沿针杆外部的聚(氯代对二甲苯)(聚对二甲苯-C)的变薄、穿透和/或开裂情况。聚对二甲苯-C在电极部位附近的成像区域应为光滑且保形的层。针杆(Shaft)评估硅胶针杆的损伤。生长(Growth)评估组织粘附或生物材料对电极的损伤。
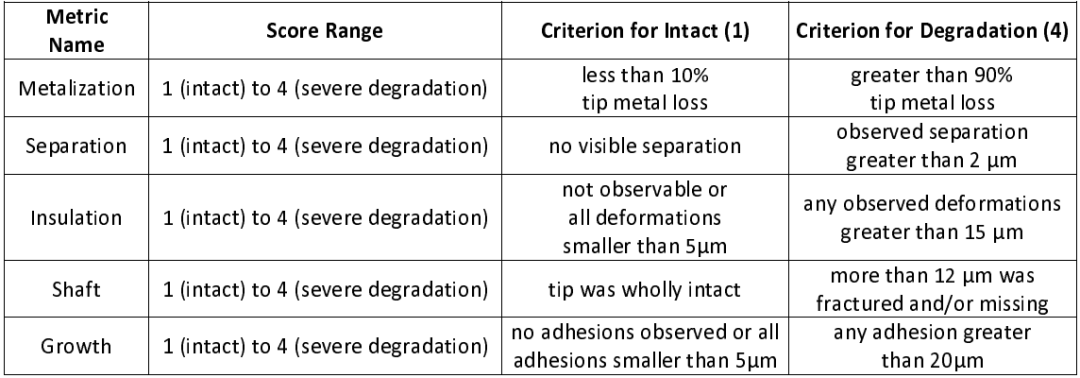
表 2 | 观察到的退化的度量标准
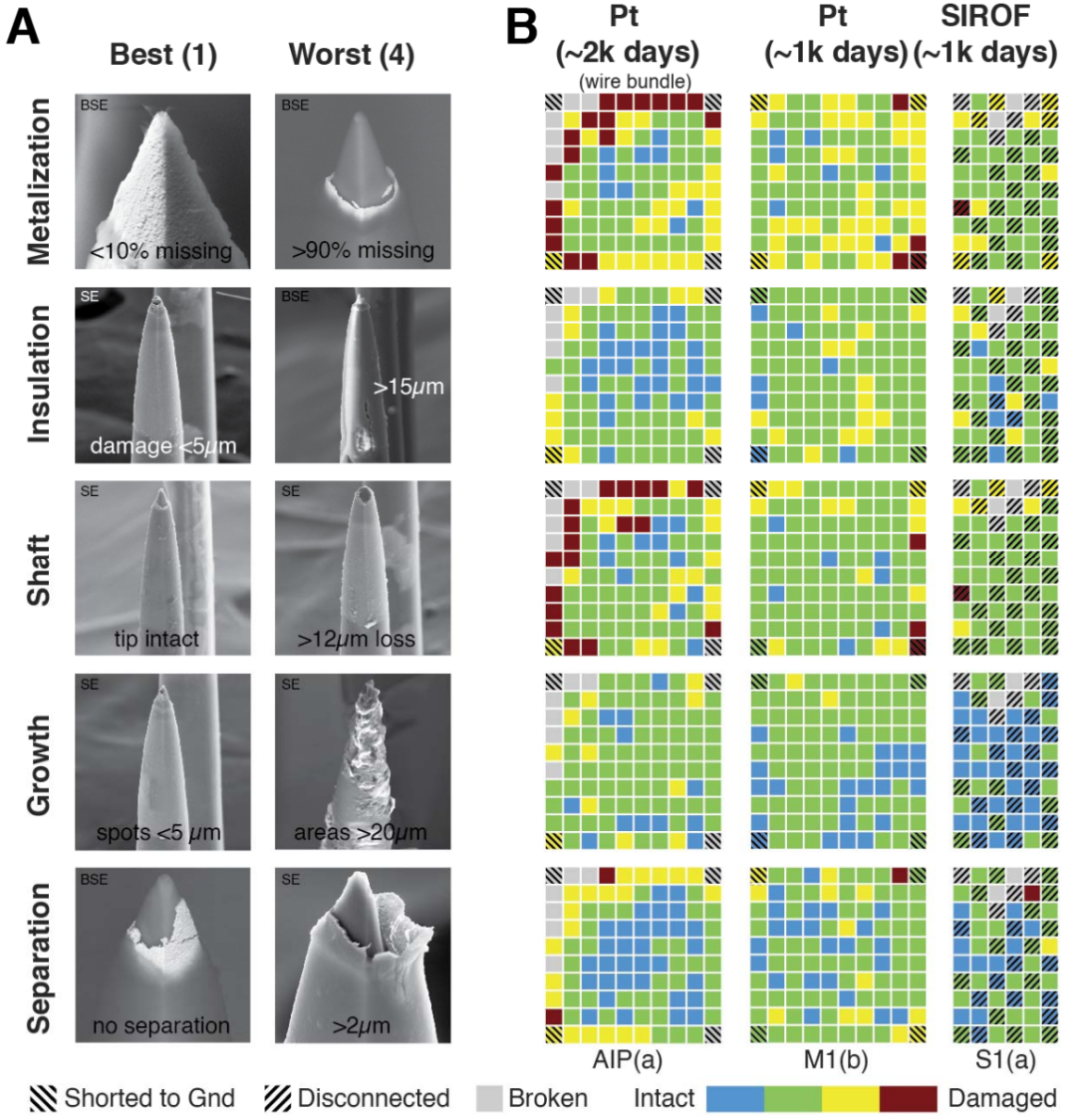
图 2 | 用于分类电极状况的电子显微镜(研究结束时)
每个电极在三个焦距强度(500x, 1250x, 2500x)下捕获扫描电子显微镜图像,包含标准图像(SE)和背散射图像(BSE)。背散射图像显示电极尖端的金属化情况,而标准图像捕获所有材料。
(A) 人类通过目视检查图像对每个电极在五个指标上进行评分,范围从1(完整)到4(损伤):金属化、绝缘、针杆、生长和分离。
(B) 由一位评审员为每个损伤指标评分的示例热图;蓝色通常表示完整电极,而红色表示损伤。未连接电极用对角线标记。完全断裂的针杆被排除在分析之外(标记为灰色)。热图对应于植入1988天的铂阵列(阵列AIP(a))、植入956天的铂阵列(M1(b))和植入956天的SIROF阵列(S1(a))。
研究结束时的阻抗和神经数据在设备取出前进行测量和量化(图3)。对于在Caltech植入的每个电极阵列,在取出前两周收集了六组宽带记录的电活动数据集,参数与纵向收集的参数相同。对于JHU/APL阵列,在取出前两个月收集了三组数据集。所有电极的阻抗均随这些数据集一起收集(图3A)。记录用于确定噪声和信噪比(SNR)。

图 3 | 电极质量的功能评估(研究结束时)
在取出前,收集了几项测量值以评估每个电极状况的功能性:阻抗、RMS噪声和信噪比。这些数据来自图1中标识的电极阵列AIP(a)、M1(b)和S1(a)。未连接电极用对角线标记,灰色框表示无数据的电极针杆。
(A) 植入超过5年的Pt阵列的示例热图。铂阵列(AIP(a)和M1(b))的阻抗显示范围为200 - 800 kΩ,SIROF阵列(S1(a))为30 - 250 kΩ。
(B) 示例阵列的RMS噪声热图。我们绘制了0 - 30 μV的RMS噪声。大于30μV显示为红色。
(C) 示例阵列的信噪比(SNR)热图。SNR范围从0到5+。
(D) 我们将每个电极表征为“能够产生感知”、“从未产生感知”或“过去能产生感知,但在寿命结束时不能”。铂电极和未连接电极从未被刺激,因此没有数据。
单个和多个单元的神经动作电位通过提取负向穿过-3.5倍RMS噪声阈值的波形来识别(图3B, 8A)。根据在每个电极上识别出的最大单个神经元的平均波形,SNR值计算为波形平均峰峰值幅度与其方差的比值(图3C, 8A)。
通过每个连接的SIROF电极传递的电刺激模式来评估电极的刺激效果。使用取出前最后六个月收集的数据,不考虑刺激模式或使用频率,对每个电极进行分类。第一类,直到研究结束仍能诱发感觉;第二类,过去能诱发感觉,但在研究结束时不能;第三类,从未诱发过感觉(图3D)。还量化了通过每个电极传递的总寿命电荷(毫库仑[mC]),以评估刺激量是否与电极损伤相关。
电极在其生命周期内的几个不同阶段可能受到损坏。一个潜在的损坏点可能发生在手术处理和插入组织的过程中。其次,慢性留置期间的非生物(设备)退化或机械故障也可能导致性能指标的变化。第三,取出或取出后的处理可能导致电极断裂或损坏。通过量化取出前(图3)记录的阻抗、SNR和刺激效果(刺激阵列),我们估计了在取出和/或运输阶段断裂的电极数量(14/672 Pt)和(12/96 SIROF)。此外,明显被破坏(>50%针杆缺失)的电极被排除在分析之外(42/980 Pt和SIROF)。因此,本次电极损伤评估侧重于留置期间潜在的非生物机制,而非手术植入和取出技术。生物降解机制(如胶质瘢痕形成)无法分析,因为在取出过程中保留了该组织以最小化研究参与者的风险。
8. 统计分析
我们使用Spearman相关性(对多重比较进行错误发现率(FDR)校正)来检验图6和图7中的显著性。莫兰指数(Moran’s I)是一种空间自相关方法,用于确定损伤指数是随机排列的(完全空间随机性(CSR)是零假设(I = 0))还是具有分散(I = -1)或相关(I = +1)的结构(图6A)。这代表了首次应用这种空间统计技术来量化微电极阵列的退化分布。对于图4中的小提琴图,我们使用非参数、双样本引导重叠置信区间比较来评估显著性。

图 4 | 所有电极和指标的热图(研究结束时)
所有分析阵列的完整空间图。通道编号从左上角开始,从左到右,从上到下。线束从该布局的顶部连接到每个阵列。比例条指示阻抗范围[kOhms]、RMS噪声范围[µV]以及由专家根据SEM图像视觉评估的平均损伤指标。对于所有比例条,蓝色通常表示完整电极,而红色表示损伤。灰色框表示阻抗([Z])、RMS噪声、SNR和刺激没有数据。视觉评估的损伤指标的灰色框表示断裂的针杆。
9. 电极分组
980个电极被分为五组:植入约2000天的铂电极(n=389/400)、植入约1000天的铂电极(n=393/400)、受刺激的SIROF电极(n=84/96)、未受刺激的SIROF电极(n=72/84)以及在制造商验证后1342天成像的对照铂电极(n=100)。
结果
来自十一个阵列的数据集提供了一个独特的机会,可以在人类皮层中长期植入的情况下,比较几种不同指标(植入时长、电极尖端材料、电刺激和电连接性)的退化特征。对于每个阵列,我们量化了专家评分的每个电极的每个指标所观察到的损伤严重程度,并将其与研究结束时记录的电生理信号和行为数据相关联(图4)。对照阵列(未植入)的电极在任何退化指标上都显示出很少的损伤迹象(图5,紫色)。

图 5 | 退化特征
人类专家视觉评分的每个指标的电极分数根据植入时长(0天:对照,~1000天,~2000天)、刺激与未连接、或尖端材料(铂与SIROF)进行分组。图显示分数分布(小提琴图)、中位数(白圈)和四分位数(黑线)。显著性通过非参数双样本引导置信区间比较进行评估,并由黑条指示。阵列特定信息的额外展示见图S1。
(A) 在大多数指标上观察到铂电极随时间推移而退化。植入仅约1000天(JHU/APL参与者)的电极的针杆损伤比植入约2000天(Caltech参与者)的电极更普遍。
(B) 我们观察到SIROF针杆在金属化、绝缘和针杆方面的损伤率显著高于Pt针杆。针杆损伤在植入JHU/APL参与者(所有电极956天)的针杆上最高。
(C) 对于在同一参与者体内植入相同时长(2.6年)的SIROF电极,我们比较了传递刺激的电极和未连接电极(见SIROF电极的空间组织图1G)上观察到的损伤。五个损伤指标中的两个(绝缘和生长)在传递刺激的电极上比在未连接电极上统计上显著更差。
(D) 比较所有电极组的详细直方图。均值和标准差显示为直方图上方的线和圆圈。按阵列的进一步细分见图S1和S2。
1. 植入时长
通过比较三组铂电极(0天:对照,~1000天,~2000天),我们观察到损伤增加与植入时长相关(图5A)。正如预期,大多数退化指标(金属化、绝缘、分离、生长;图S1)显示出正相关。然而,我们也观察到在~1000天植入的Pt电极中,针杆损伤量显著高于~2000天的电极(图4A – 针杆)。观察到阵列M1(c)具有明显更高的针杆损伤水平,这是造成差异的一个机制。在SEM图像中观察到针杆厚度的微小变化,很可能是由于制造差异造成的,这可能是针杆指标差异的一个原因。
2. 铂金与SIROF
在取出时,SIROF电极记录到神经活动的可能性几乎是铂电极的两倍(图4,SNR),尽管它们在相同参与者体内植入相同时长。对于SIROF电极,67/96的SNR > 1,而Pt电极只有97/288。值得注意的是,我们观察到SIROF电极通常比其Pt对应物具有显著更高的损伤(图5B,p < 0.05,非参数,引导置信区间)。由于分布类型各异,这些显著性检验不依赖于假设的分布,然而众数/平均值并不总能准确代表数据(图5D)。
我们观察到SIROF电极的尖端金属损伤显著多于Pt电极。然而,受刺激的SIROF电极与未连接的对应物在金属化损伤方面没有显著差异(图5C,图S2A)。这可能表明刺激并非造成SIROF和Pt之间金属化退化增加的原因。在另一项分析中,我们确定传递的电荷量与我们任何退化指标的增加损伤均无相关性(图7B,p > 0.05,Spearman’s rho)。SIROF电极的绝缘和针杆损伤显著更高(p < 0.05)(图S2A – 针杆,绝缘);然而,Pt电极的组织生长显著更高。此外,Pt电极更可能出现尖端金属与针杆之间的分离。
3. 参与者特异性效应
我们还观察到同一参与者内部不同阵列上相同类型电极的退化指标存在差异(图4,指标:金属化,阵列:M1a, M1b vs. M1c)。虽然两个Pt阵列(JHU/APL: M1a, M1b)的金属化、分离和针杆损伤如预期低于植入时间更长的电极(图S1B,C vs. S1D),但植入在同侧半球(JHU/APL: M1c)的阵列在损伤程度上明显是个异常值,尽管是相同的电极类型(Pt)且植入时长(956天)与M1a和M1b相同。
我们还观察到在不同参与者中植入相似时长的铂电极之间存在显著差异(图S1B,C)。第二位Caltech参与者(图S1C)阵列的金属化和分离损伤明显高于第一位(图S1B)。
4. 受刺激 vs. 未连接电极 (SIROF)
研究刺激对人类皮层的影响以及此类电极的寿命是本研究的一个关键目标。在每个SIROF阵列的60个电极中,有28个电极未电连接(悬空)(图1G)。这些电极提供了一个很好的对照,用于评估仅由电连接、刺激或其组合引起的潜在损伤。由于SIROF阵列上连接和未连接电极的棋盘格模式(图1G),受刺激和未连接电极在空间上是均匀分布的。
在SEM检查的损伤指标中,我们未观察到受刺激和未受刺激电极之间的退化存在许多显著变化(图5C,图S2)。绝缘损伤有轻微但显著的增加,并且观察到受刺激电极上的生长也有所增加。
5. 与刺激相关的损伤类型
虽然电极检查未显示受刺激和未连接电极在金属化损伤量方面存在显著差异(图5C),但我们确实在损伤类型上发现了显著差异(图6B,裂纹状 vs. 麻点状)。在铂电极上观察到的大多数金属化损伤(图6A)可以被描述为金属的“开裂”或“剥落”,从硅针杆上剥离(图6D)。

图 6 | 尖端金属损伤
我们观察并量化了两种类型的尖端金属退化:裂纹/剥落(图中蓝色表示)和麻点状(红色表示)。
(A) 麻点状电极尖端存在于大多数阵列上,但在SIROF尖端上最为普遍。大多数阵列超过80%的电极存在某种金属损伤。
(B) 当比较受刺激的电极与未连接的电极时,我们可以观察到刺激特异性效应。麻点状退化特征在刺激电极上的出现频率显著高于未连接电极。刺激电极也比未连接电极更可能出现金属损伤。
(C) 通过SIROF阵列(S1(a)、S1(b)、S1(c)合并)中每个受损电极传递的总电荷以毫库仑(mC)绘制。尖端金属退化类型与传递的总电荷量无关。
(D) 具有裂纹/剥落金属的SIROF电极的SEM背散射图像。更多示例见图S3。
(E) 显示麻点状金属退化的SIROF电极的SEM背散射图像。
我们观察到一种不同类型的金属化损伤,我们将其命名为“麻点状”(pockmarked),主要发生在受刺激的SIROF电极上。这种损伤也可以描述为尖端金属的“成珠”、“熔化”或“凝结”。它让人联想到热损伤,但在区分这两组人群的体内条件下,没有普遍报道的发生这种损伤的机制。这种金属变形没有发生显著的温度变化。电化学界面上的电势(Emc)预计不足以驱动可能导致金属沉积的冶金反应,而金属沉积是形成圆形金属沉积物的机制。此外,该损伤导致硅针杆在金属化层下暴露。似乎SIROF材料熔化并重新附着在硅针杆上形成小结节(图6E),推测可能是由表面电势的局部梯度引起的。
这种观察到的“麻点状”损伤在刺激电极上发生的频率显著高于未连接电极(图6B),表明刺激可能加速或增强了这种形式的金属化损伤,而不是更典型的“开裂”或“剥落”。然而,它在铂电极上也少量存在,因此刺激并非这种退化机制发生的唯一途径(图6A)。我们还比较了通过每个刺激电极传递的总电荷量,未发现与金属化退化类型之间存在显著相关性(图6C),这进一步证明低电流刺激并未加剧超出人类皮层慢性植入所引起的损伤。
6. 空间相关的损伤
大多数评估的损伤指标在空间上显著相关(图6A)。使用莫兰指数(Moran’s I)(一种空间自相关性的度量,-1表示完全分散的模式,1表示完全空间相关),我们观察到SEM检查的损伤指标与电极寿命结束时的性能测量之间存在显著的空间相关性。电极周围的体内环境预计不会存在导致观察到的相关性和损伤分组的成分巨大差异。这种梯度可能由于边缘电极更容易接触化学物质,以及阵列内部电极的血管通路减少而存在。边缘电极在制造和处理过程中更容易受损,这种损伤可能导致体内退化。
7. 所有损伤指标之间的显著相关性
观察到的电极生理损伤影响了多个损伤指标,而不仅仅是单一特征(图7C)。对于SIROF电极,电极上的生长量与其他所有指标显著相关(rho > 0.5),表明可能是其他退化特征的机制驱动因素。对于SIROF和Pt电极,金属化和分离具有最高的相关性(rho > 0.75)。
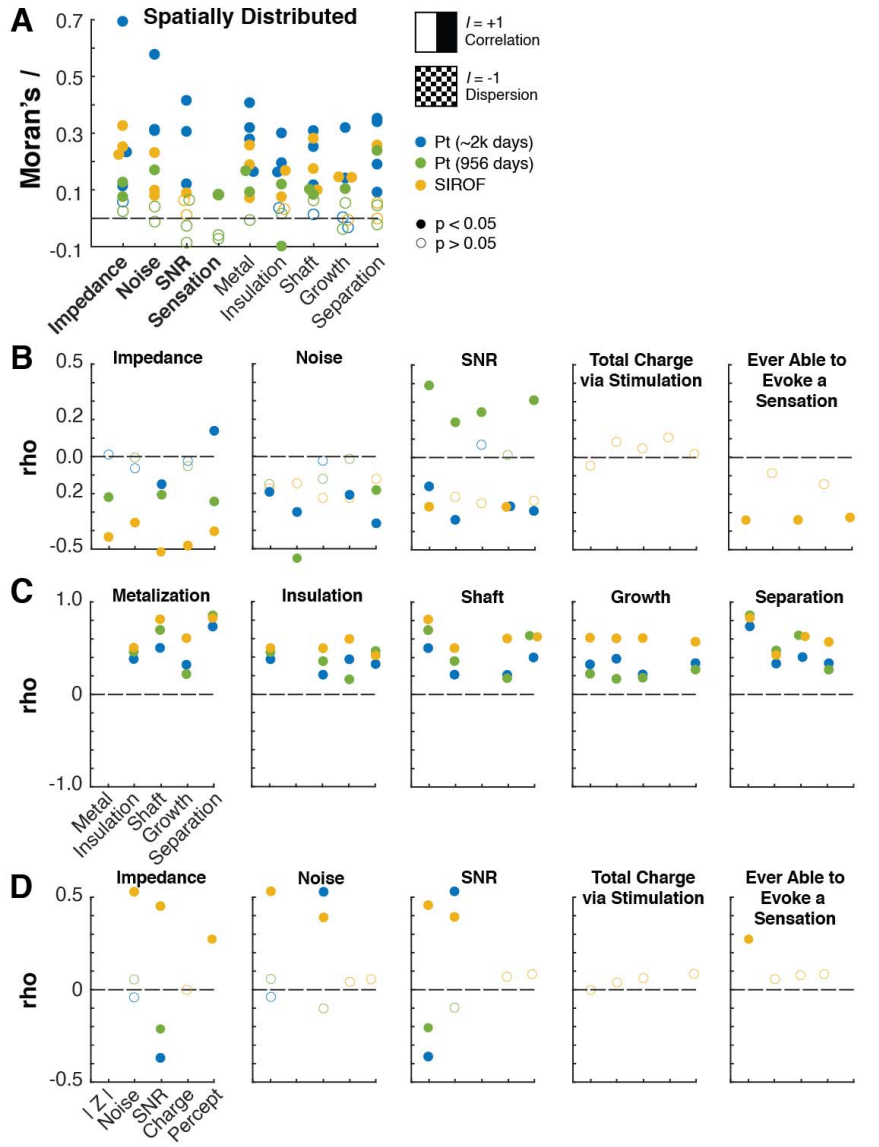
图 7 | 观察到的损伤分析
我们评估了损伤指标(金属化、绝缘、针杆、生长、分离)与研究结束时指标(SNR、阻抗、噪声)之间的关系。填充圆圈表示统计显著性(p<0.05p<0.05)。
(A) 使用莫兰指数(Moran’s I)(一种空间自相关性的度量),我们观察到的大多数指标在空间上相关,表明损伤并非由植入/取出程序引起,而是由生物分解或组织相互作用导致。
(B) 我们评估了损伤指标与研究结束时指标之间的Spearman's rho相关性。阻抗与SIROF电极的所有损伤指标显著相关,但与Pt电极相关性较弱。通过刺激传递的总电荷量与任何损伤指标均无显著相关。
(C) 所有损伤指标彼此正相关,表明没有任何一个指标是孤立发生的。金属和分离指标在所有组中具有最高的相关性(r>0.75r>0.75),而对于SIROF电极,生长与所有其他组正相关。这表明对于这些类型的电极,可能存在一种退化的机制驱动因素。
(D) SIROF电极在以下方面存在显著正相关:阻抗与RMS噪声,阻抗与SNR,以及RMS噪声与SNR。植入956天后取出的Pt电极在阻抗与SNR之间呈显著负相关。植入2246天后取出的Pt电极在阻抗与SNR之间呈显著负相关,在RMS噪声与SNR之间呈显著正相关。通过刺激传递的总电荷量与其他任何研究结束时的测量值均无相关性。铂和SIROF在阻抗与SNR之间呈相反的相关性,检测单单元的最佳阻抗可能位于SIROF电极的较高范围和铂电极的较低范围内的某个位置,这个过程可能涉及尖端材料和脱绝缘长度。
8. 电极功能与损伤指标之间的相关性
本研究的一个主要目标是将观察到的电极退化与电极功能联系起来:记录神经活动和传递刺激(仅针对SIROF)。我们计算了每个研究结束时的电生理测量值与SEM损伤指标之间的相关性(图7B)。
9. 阻抗与SIROF电极的记录、刺激性能和退化相关
我们发现阻抗与通过SEM观察到的SIROF电极的所有损伤指标高度相关(Spearman’s rho,FDR校正),但与Pt电极无关(图7B)。这一发现表明,对于SIROF电极,阻抗是电极损伤的良好度量,应在整个植入寿命期间持续测量以监测电极性能。
阻抗与SIROF电极的记录性能显著相关。尽管SIROF电极的噪声更高(图8A,噪声),但它们实现了优越的单单元记录特性(图8A,信噪比)。噪声和SNR均与阻抗测量值显著正相关(图7D,阻抗)。
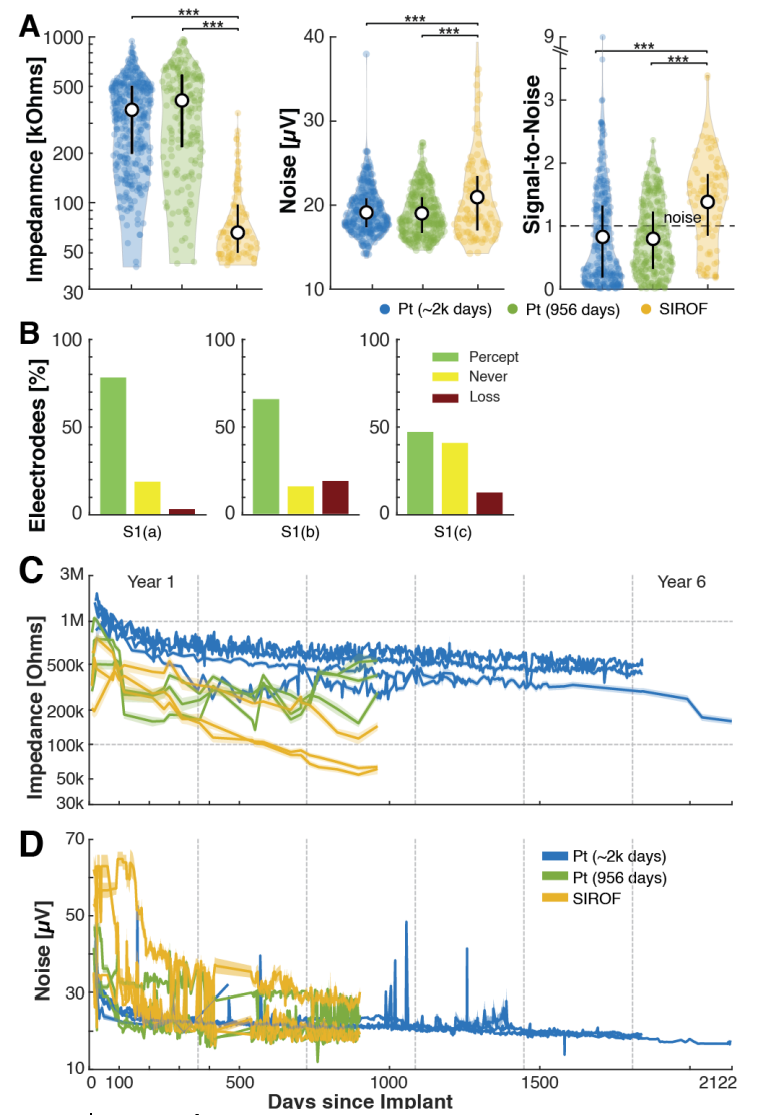
图 8 | 电极功能
在植入的整个持续期间和取出前直接收集了电极健康状况的纵向测量值。
(A) 正如预期,在研究结束时,两组Pt电极的测量阻抗均显著高于SIROF。SIROF的RMS噪声也显著更高,但记录性能(通过信噪比SNR衡量)也更高。SNR计算为平均峰峰值波形与其方差的比值。
(B) 对于每个SIROF阵列,大多数电极在其生命周期内的某个时刻能够诱发感觉(绿色 + 红色)。少量电极在取出前停止诱发感觉(红色)。
(C) 所有电极的阻抗在植入后初期都高于其指定范围。它们通常在植入后100天内迅速稳定到各自的运行范围。
(D) 噪声通过RMS计算进行评估,并在植入后前200天后保持相对稳定。噪声值通常随时间下降,偶尔出现较大的异常值。这些异常值通常对应于信号中的噪声、模拟电缆中灯丝的退化或其他环境噪声源。阴影误差条表示给定阵列上所有电极均值的1个标准误。
阻抗也与SIROF电极的刺激性能显著相关(图7D,感觉)。SIROF电极创造体感知觉的功能能力(图8B)与几个损伤指标显著负相关(图7B),表明电极损伤增加可能降低诱发感觉的可能性。重要的是,我们发现受刺激SIROF电极传递的总电荷量与任何损伤指标均无显著相关性(图7B)。
与SIROF电极相反,阻抗和SNR在铂电极上呈负相关(图7D,阻抗);这表明较低阻抗的Pt电极和较高阻抗的SIROF电极具有最高的SNR值。
10. 纵向电极性能
所有电极都表现出阻抗和噪声随时间下降的趋势,这与其他研究小组的分析一致。这种下降通常归因于封装退化,这可能与更大表面积上的平均化导致噪声降低相一致。这表明检测信号单元的最佳阻抗和噪声特性取决于电极材料、暴露面积和相关噪声特性之间复杂的相互作用。
重要的是,在纵向阻抗和噪声之间存在趋势(图8C,D)。在早期时间点,SIROF阵列具有显著更高的噪声值和显著更低的阻抗。大多数电极在植入后立即出现阻抗的初始高峰,然后逐渐衰减,在第一年内达到标称范围(Pt为200-800 kOhm,SIROF为80-200 kOhms)。RMS噪声通常在植入后前100天后稳定在标称范围(14-28 µV)(阵列S1(c)除外)。对于铂阵列,这种“稳定”发生得更快,通常在植入后前25-50天内。
讨论
本研究的一个主要目标是量化慢性植入的Neuroport电极的状况和可能的损伤,并将观察到的损伤与植入物整个生命周期内可用的、可测量的数据联系起来。我们检查了植入三个不同BMI参与者的980个电极,比较了植入时长、电极类型、连接与未连接、电刺激以及电刺激传递的电荷量的影响。我们使用扫描电子显微镜对所有电极进行了成像,并评估了每个电极的五个损伤组成部分,包括金属化、绝缘、针杆、生长和分离。我们还在取出前捕获了研究结束时的测量值:阻抗、RMS噪声、SNR和刺激功能。
总的来说,我们观察到植入时间越长的电极损伤越严重。我们的数据显示电极损伤与传递的刺激量之间没有相关性,但我们确实在SIROF刺激阵列的连接(有导线)与未连接电极之间看到了显著差异。我们还发现了一种新的退化特征(称为“麻点状”),与先前传递的刺激相关,但也出现在少数Pt电极上。阻抗测量值与以下方面显著相关:1) 通过SEM观察到的SIROF电极的所有五个损伤指标,2) 以SNR衡量的记录性能,以及3) 刺激性能,这表明阻抗可能是此类电极的有效性能测量指标。尽管在研究结束时SIROF电极的记录性能更好(通过更高的SNR值衡量),但与铂电极相比,SIROF电极的损伤情况更差;这表明这些电极尽管有损伤,但在捕获单单元活动方面可能更优。
1. 阻抗与SIROF电极观察到的损伤强相关,但与Pt电极无关
在缺乏任何其他定义的指标或可观察变量的情况下,测量电极阻抗长期以来一直是确定体内电极健康状况的金标准。然而,正如电生理学家非常普遍注意到的,1 kHz阻抗幅度与信号性能之间的相关性充其量是微弱的。本研究证实了这些对铂电极的担忧,因为其阻抗与观察到的损伤相关性较弱(图7B – 阻抗:蓝色,绿色)。然而,从SIROF电极收集的阻抗与所有观察到的损伤指标强相关(图7B – 阻抗:黄色)。正如先前研究所预期的那样,阻抗通常随时间下降(图8C),这可能是由于封装、金属化破裂、暴露电极表面积增加等因素共同作用的结果。这种材料和暴露的表面积在这种阻抗变化中起着重要作用,如文献所述[47]。这种纵向趋势与随时间增加的退化相关,然而在我们逐个电极的数据中,只有SIROF电极的阻抗可靠地与所有损伤指标相关(图7B)。
2. 提出的退化机制
我们观察到多种电极金属化失效模式,并试图描述这种退化的潜在时间线和机制(图S3)。我们观察到高度损坏尖端金属的电极出现频率很高(图3,金属化);然而,一些电极仍保持近乎完美的状态(图S3A)。被评为“完整”(Intact)(图S3A,B,C)的电极没有缺陷或仅有轻微损伤,包括电极最顶端和/或尖端底部金属化层的细线裂纹或孔洞(图S3C)。虽然金属化层下方可能存在损伤,如先前观察到的,但这些结果表明实现电极的更高稳定性是可能的。每当我们观察到尖端金属上的孔洞时,我们也观察到下方硅针杆的蚀刻,这可能导致金属和硅之间的分离(图S3D-I)。在严重蚀刻/侵蚀的情况下,我们观察到尖端金属的剥落,通常可以在图像中看到这种残留的碎片(图S3G-i)。在最坏的情况下,我们观察到由于底切(undercutting)导致几乎所有金属被机械移除(图S3J)和/或硅针杆被严重蚀刻(图S3K,i)。在几种情况下,多个电极的硅针杆中出现方向一致的断裂面,可能使它们更容易受到蚀刻影响,导致电极大部分剥落。通过仔细评估断裂面,可以对这种断裂的时间线进行一些评估。脆性断裂面呈现出镜面区、雾状区和放射区,后者具有尖锐清晰的特征。先前和当前的观察表明,硅表面具有平滑的特征,与在体内被蚀刻一致。这些特征通常与金属化和硅之间的分离同时出现,为硅溶解导致特征平滑提供了证据。观察到同时具有尖锐和平滑特征的电极,但量化这些特征超出了本工作的范围。
观察到的电极寿命变化的部分原因可能是制造差异(这些将是未受控的噪声变量);然而,确定这一点超出了本数据集的范畴。此外,严格测试我们假设的硅胶腐蚀机制需要大量的实验,最好通过台架研究(如电化学腐蚀研究)来识别机制。随后可以通过动物研究来验证退化机制或缓解策略,类似于先前对犹他阵列和密歇根探针的研究。诸如掺杂浓度、尖端金属化和封装层的完整性或潜在的其他工艺因素等因素可能会影响硅基神经电极的寿命和性能。
3. 高度损伤的电极仍能产生良好的神经记录
一些观察到“高度损伤”的电极在研究结束时的测量中捕获到了高质量的神经信号。一个示例电极(图S3 – 阵列AIP(a), 通道#5),在金属化和针杆损伤方面得分最差(4分),在分离损伤方面得分第二差(3分)。然而,在研究结束时的测量中,该电极的SNR为2,意味着记录到了一个显著大的单单元波形,同时阻抗测量值看起来在标称范围内。
两种解释可能与这种不一致性相符。首先,金属和硅之间电连接性的物理表征可能难以准确判断。获得的SEM图像覆盖了圆形电极约180-270度的范围,在电极背面留下了一个小的盲点,无法观察到可能有利于记录的区域。对电功能性的精确测试(即植入后阻抗测量)可能更准确地捕获此类信息;然而,由于取出过程中的手术要求,基座和阵列之间的有线连接被切断,使得此类测量无法进行。其次,少量物理和电气上附着在硅针杆上的金属,以及底切表面和其他特征,提供了足以实现记录的表面积。这些结果表明,仅需很小的电极面积就可能捕获神经信号。在这种最佳情况下,电极可能能够承受显著的损伤,但仍能保持记录功能。
无论未来的研究证实哪种假设,我们的观察确实为电极能够在已知退化的情况下持续良好运行超过1000天的慢性植入期提供了一些解释依据。
4. 刺激电极的有限退化
在三个刺激阵列和通过SEM成像观察到的五个退化指标中,我们发现了刺激引起额外损伤的部分证据(图5,图S2)。被刺激的电极显示出显著更高的绝缘损伤和附着在电极上的组织生长。与先前在更短时间尺度(182天)的研究结果相反,我们没有观察到金属化损伤的增加。考虑到植入前六个月期间阻抗和炎症反应的巨大变化,在先前的研究中,电极界面可能尚未稳定。
虽然金属化损伤的发生率在刺激与非刺激SIROF电极之间没有显著差异,但我们的成像揭示了一种新型电极尖端金属退化,主要出现在受刺激电极上(图6B)。这种“麻点状”退化在视觉特征上与通常观察到的“裂纹/剥落”金属退化(图5D vs. 5E)明显不同。这种新的“麻点状”金属化损伤也在未受刺激的铂和SIROF电极上观察到(图5A,B),尽管发生率低得多。我们假设刺激可能加速了这种损伤类型,但不是唯一原因,因为它并非刺激电极所独有。
此外,通过刺激(SIROF)电极传递的总电荷量与我们的任何视觉评估损伤指标(图6B – 刺激)或损伤类型(图5C)均无显著相关。对SIROF电极功能(诱发感觉的能力)的评估也与任何研究结束时的测量值或损伤指标无关,这与一些先前的研究形成对比。
一些取出研究显示电极金属化损伤与刺激之间存在显著相关性;尽管最大总传递电荷量仅为0.08 mC,植入时间仅为182天。在我们的研究中,电极被刺激的总电荷量高达8 mC,植入时间为956天,并且它们在任何一个阵列上都没有显示出这种相关性(图6)。
5. 外植体程序
对三位参与者进行比较的一个限制是取出程序的差异。鉴于三个不同的临床试验地点、涉及的三位不同的神经外科医生以及每位参与者手术程序的新颖性,制造商没有关于阵列移除、处理或储存的协议。虽然超出了本研究范围,制造商和其他相关方制定标准化的取出程序(用于设备移除、处理、储存和研究结束时的测量)以评估植入期间可能发生的电极退化可能是有益的。
6. 组织学
与其他植入到将被切除组织中的分析不同,植入这些阵列的组织在取出时无法用于切除或进一步分析,因为参与者当时仍然在世。我们小组先前关于人类皮层慢性植入电极引起组织损伤的分析显示,植入部位淋巴细胞浸润、星形胶质细胞增生和异物反应增加,以及血管破坏和植入手术引起的微出血迹象。在所有取出记录中,相应的神经外科医生都观察到取出后皮层中留下的典型压痕(图S5),与其他临床前和临床研究报告相似。
参考文献
1. E. M. Maynard, C. T. Nordhausen, and R. A. Normann, "The Utah Intracortical Electrode Array: A recording structure for potential brain-computer interfaces," _Electroencephalogr. Clin. Neurophysiol._, vol. 102, no. 3, pp. 228–239, 1997, doi: 10.1016/S0013-4694(96)95176-0.
2. P. R. Kennedy and R. A. E. Bakay, "Restoration of neural output from a paralyzed patient by a direct brain connection.," _Neuroreport_, vol. 9, no. 8, pp. 1707–11, Jun. 1998, doi: 10.1097/00001756-199806010-00007.
3. E. E. Fetz, "Real-time control of a robotic arm by neuronal ensembles," _Nat. Neurosci._, vol. 2, no. 7, pp. 583–584, 1999, doi: 10.1038/10131.
4. J. Wessberg et al., "Real-time prediction of hand trajectory by ensembles of cortical neurons in primate," _Nature_, vol. 408, no. 1, pp. 361–365, 2000.
5. M. D. Serruya, N. G. Hatsopoulos, L. Paninski, M. R. Fellows, and J. P. Donoghue, "Instant neural control of a movement signal.," _Nature_, vol. 416, no. 6877, pp. 141–2, Mar. 2002, doi: 10.1038/416141a.
6. D. M. Taylor, "Direct Cortical Control of 3D Neuroprosthetic Devices," _Science (80-. )._, vol. 296, no. 5574, pp. 1829–1832, Jun. 2002, doi: 10.1126/science.1070291.
7. M. Velliste, S. Perel, M. C. Spalding, A. S. Whitford, and A. B. Schwartz, "Cortical control of a prosthetic arm for self-feeding," _Nature_, vol. 453, no. 7198, pp. 1098–1101, 2008, doi: 10.1038/nature06996.
8. L. R. Hochberg et al., "Reach and grasp by people with tetraplegia using a neurally controlled robotic arm.," _Nature_, vol. 485, no. 7398, pp. 372–5, May 2012, doi: 10.1038/nature11076.
9. J. L. Collinger et al., "High-performance neuroprosthetic control by an individual with tetraplegia," _Lancet_, vol. 381, no. 9866, pp. 557–564, 2013, doi: 10.1016/S0140-6736(12)61816-9.
10. B. Woollinger, J. E. Downey, E. C. Tyler-Kabara, A. B. Schwartz, M. L. Boninger, and J. L. Collinger, "Ten-dimensional anthropomorphic arm control in a human brain-machine interface: difficulties, solutions, and limitations," _J. Neural Eng._, vol. 12, no. 1, p. 016011, Feb. 2015, doi: 10.1088/1741-2560/12/1/016011.
11. R. A. Andersen, T. Affalo, L. Bashford, D. Bjanes, and S. Kellis, "Exploring Cognition with Brain-Machine Interfaces," _https://doi.org/10.1146/annurev-psych-030221-030214_, vol. 73, no. 1, pp. 131–158, Jan. 2022, doi: 10.1146/ANNUREV-PSYCH-030221-030214.
12. S. Musallam, B. D. Cornell, B. Greger, H. Scherberger, and R. A. Andersen, "Cognitive control signals for neural prosthetics," _Science (80-. )._, vol. 305, no. 5681, pp. 258–262, 2004, doi: 10.1126/science.1097938.
13. C. Pandarinath et al., "High performance communication by people with paralysis using an intracortical brain-computer interface," _Eiffe_, vol. 6, Feb. 2017, doi: 10.7554/EIFFE.18554.
14. S. K. Wandelt, D. A. Bjanes, K. Pejsa, B. Lee, C. Liu, and R. A. Andersen, "Online internal speech decoding from single neurons in a human participant," _medRxiv_, p. 2022.11.02.22281775, Nov. 2022, doi: 10.1101/2022.11.02.22281775.
15. R. A. Normann and E. Fernandez, "Clinical applications of penetrating neural interfaces and Utah Electrode Array technologies," _J. Neural Eng._, vol. 13, no. 6, p. 061003, Oct. 2016, doi: 10.1088/1741-2560/13/6/061003.
16. M. A. Salas et al., "Proprioceptive and cutaneous sensations in humans elicited by intracortical microstimulation," _Eiffe_, vol. 7, 2018, doi: 10.7554/elife.32904.
17. S. N. Flesher et al., "Intracortical microstimulation of human somatosensory cortex," _Sci. Transl. Med._, vol. 8, no. 361, p. 361ra141, Oct. 2016, doi: 10.1126/scitranslmed.aaf8083.
18. M. S. Fifer et al., "Intracortical Somatosensory Stimulation to Elicit Fingertip Sensations in an Individual With Spinal Cord Injury," _Neurology_, p. 10.1212/WNL.0000000000013173, 2021, doi: 10.1212/wnl.0000000000013173.
19. E. Fernandez et al., "Visual percepts evoked with an intracortical 96-channel microelectrode array inserted in human occipital cortex," _J. Clin. Invest._, vol. 131, no. 23, Dec. 2021, doi: 10.1172/JCI151331.
20. X. Chen, F. Wang, E. Fernandez, and P. R. Roelfsema, "Shape perception via a high-channel-count neuroprosthesis in monkey visual cortex," _Science (80-. )_, vol. 370, no. 6521, Dec. 2020, doi: 10.1126/SCIENCE.ABD7435/SUPPL_FILE/ABD743556.MP4.
21. C. L. Hughes et al., "Neural stimulation and recording performance in human sensorimotor cortex over 1500 days," _J. Neural Eng._, vol. 18, no. 4, Aug. 2021, doi: 10.1088/1741-2552/AC18AD.
22. J. D. Simeral, S. P. Kim, M. J. Black, J. P. Donoghue, and L. R. Hochberg, "Neural control of cursor trajectory and click by a human with tetraplegia 1000 days after implant of an intracortical microelectrode array," in _Journal of Neural Engineering_, Apr. 2011, vol. 8, no. 2, doi: 10.1088/1741-2560/8/2/025027.
23. J. E. Downey, N. Schwed, S. M. Chase, A. B. Schwartz, and J. L. Collinger, "Intracortical recording stability in human brain-computer interface users," _J. Neural Eng._, vol. 15, no. 4, May 2018, doi: 10.1088/1741-2552/AAB7A0.
24. X. Chen et al., "Chronic stability of a neuroprosthesis comprising multiple adjacent Utah arrays in monkeys," _J. Neural Eng._, vol. 20, no. 3, Jun. 2023, doi: 10.1088/1741-2552/ACE07E.
25. S. Suner, M. R. Fellows, C. Vargas-Irwin, G. K. Nakata, and J. P. Donoghue, "Reliability of signals from a chronically implanted, silicon-based electrode array in non-human primate primary motor cortex," _IEEE Trans. Neural Syst. Rehabil. Eng._, vol. 13, no. 4, pp. 524–541, 2005, doi: 10.1109/TNSRE.2005.857687.
26. C. A. Chestek et al., "Long-term stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex," _J. Neural Eng._, vol. 8, no. 4, Aug. 2011, doi: 10.1088/1741-2560/8/4/045005.
27. J. D. Simeral, S. P. Kim, M. J. Black, J. P. Donoghue, and L. R. Hochberg, "Neural control of cursor trajectory and click by a human with tetraplegia 1000 days after implant of an intracortical microelectrode array," _J. Neural Eng._, vol. 8, no. 2, 2011, doi: 10.1088/1741-2560/8/2/025027.
28. J. C. Barrese et al., "Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates," _J. Neural Eng._, vol. 10, no. 6, 2013, doi: 10.1088/1741-2560/10/6/066014.
29. J. A. George et al., "Long-term performance of Utah slanted electrode arrays and intramuscular electromyographic leads implanted chronically in human arm nerves and muscles," _J. Neural Eng._, vol. 17, no. 5, p. 056042, Oct. 2020, doi: 10.1088/1741-2552/ABC025.
30. M. M. Straka, B. Shafer, S. Vasudevan, C. Welle, and L. Rieth, "Characterizing Longitudinal Changes in the Impedance Spectra of In-Vivo Peripheral Nerve Electrodes," _Micromachines 2018, Vol. 9, Page 587_, vol. 9, no. 11, p. 587, Nov. 2018, doi: 10.3390/M19110587.
31. A. Prasad et al., "Abiotic-biotic characterization of Pt/Ir microelectrode arrays in chronic implants," _Front. Neuroeng._, vol. 7, no. FEB, p. 2, Feb. 2014, doi: 10.3389/FNENG.2014.00002/BIBTEX.
32. T. D. Y. Kozai et al., "Mechanical failure modes of chronically implanted planar silicon-based neural probes for laminar recording," _Biomaterials_, vol. 37, pp. 25–39, Jan. 2015, doi: 10.1016/J.BIOMATERIALS.2014.10.040.
33. K. Woeppel, Q. Yang, and X. T. Cui, "Recent advances in neural electrode–tissue interfaces," _Curr. Opin. Biomed. Eng._, vol. 4, pp. 21–31, Dec. 2017, doi: 10.1016/J.COBM.E.2017.09.003.
34. V. S. Polikov, P. A. Tresco, and W. M. Reichert, "Response of brain tissue to chronically implanted neural electrodes," _J. Neurosci. Methods_, vol. 148, no. 1, pp. 1–18, 2005, doi: 10.1016/j.jneumeth.2005.08.015.
35. J. W. Salatino, K. A. Ludwig, T. D. Y. Kozai, and E. K. Purcell, "Gilal responses to implanted electrodes in the brain," _Nat. Biomed. Eng._, vol. 1, no. 11, pp. 862–877, Nov. 2017, doi: 10.1038/S41551-017-0154-1.
36. L. J. Szymanski et al., "Neuropathological effects of chronically implanted, intracortical microelectrodes in a tetraplegic patient," _J. Neural Eng._, vol. 18, no. 4, pp. 460–469, Aug. 2021, doi: 10.1088/1741-2552/ac127e.
37. A. Woolley, H. Desai, K. O.-J. of neural engineering, and undefined 2013, "Chronic intracortical microelectrode arrays induce non-uniform, depth-related tissue responses," _Iopscience.iop.orgAi Woolley, HA Desai, KI Ottolournal neural Eng. 2013*iosscience.iop.org_, vol. 10, no. 2, Apr. 2013, doi: 10.1088/1741-2560/10/2/026007.
38. J. C. Barrese, J. Aceros, and J. P. Donoghue, "Scanning electron microscopy of chronically implanted intracortical microelectrode arrays in non-human primates," _J. Neural Eng._, vol. 13, no. 2, p. 026003, Jan. 2016, doi: 10.1088/1741-2560/13/2/026003.
39. C. F. Dunlap, S. C. Colachis, E. C. Meyers, M. A. Bockbracher, and D. A. Friedenberg, "Classifying Intracortical Brain-Machine Interface Signal Disruptions Based on System Performance and Applicable Compensatory Strategies: A Review," _Front. Neurorobot._, vol. 14, Oct. 2020, doi: 10.3389/FNBOT.2020.558987/FULL.
40. G. Buzsaki, "Large-scale recording of neuronal ensembles," _Nat. Neurosci._, vol. 7, no. 5, pp. 446–451, May 2004, doi: 10.1038/NN1233.
41. A. B. Schwartz, X. T. Cui, D. J. J. Weber, and D. W. Moran, "Brain-Controlled Interfaces: Movement Restoration with Neural Prosthetics," _Neuron_, vol. 52, no. 1, pp. 205–220, 2006, doi: 10.1016/j.neuron.2006.09.019.
42. P. J. Rousche and R. A. Normann, "Chronic recording capability of the utah intracortical electrode array in cat sensory cortex,” J. Neurosci. Methods, vol. 82, no. 1, pp. 1–15, 1998, doi:10.1016/S0165-0270(98)00031-4.
43. A. Degenhart, J. Eles, R. Dum, … J. M.-J. of neural, and undefined 2016, “Histological evaluation of a chronically-implanted electrocorticographic electrode grid in a non-human primate,” iopscience.iop.orgAD Degenhart, J Eles, R Dum, JL Mischel, I Smailanchuk, B Endler, RC AshmoreJournal neural Eng. 2016*iopscience.iop.org, vol. 13, no. 4, Jun. 2016, doi:10.1088/1741-2560/13/4/046019.
44. E. M. Schmidt, J. S. Mcintosh, and M. J. Bak, “Long-term implants of Parylene-C coated microelectrodes,” Med. Biol. Eng. Comput., vol. 26, no. 1, pp. 96–101, Jan. 1988, doi:10.1007/BF02441836.
45. X. Xie et al., “Long-term reliability of AI2O3 and Parylene C bilayer encapsulated Utah electrode array based neural interfaces for chronic implantation,” J. Neural Eng., vol. 11, no. 2, p. 9, 2014, doi:10.1088/1741-2560/11/2/026016.
46. R. Caldwell, M. G. Street, R. Sharma, P. Takmakov, B. Baker, and L. Rieth, “Characterization of Parylene-C degradation mechanisms: In vitro reactive accelerated aging model compared to multiyear in vivo implantation,” Biomaterials, vol. 232, p. 119731, Feb. 2020, doi:10.1016/J.BIOMATERIALS.2019.119731.
47. R. Caldwell et al., “Neural electrode resilience against dielectric damage may be improved by use of highly doped silicon as a conductive material,” J. Neurosci. Methods, vol. 293, pp. 210–225, Jan. 2018, doi:10.1016/J.JNEUMETH.2017.10.002.
48. P. Ghelich, N. F. Nolta, and M. Han, “Unprotected sidewalls of implantable silicon-based neural probes and conformal coating as a solution,” Npi Mater. Degrad., vol. 5, no. 1, Dec. 2021, doi:10.1038/S41529-021-00154-9.
49. S. Negi, R. Bhandari, L. Rieth, and F. Solzbacher, “In vitro comparison of sputtered iridium oxide and platinum-coated neural implantable microelectrode arrays,” Biomed. Mater., vol. 5, no. 1, p. 15007, 2010, doi:10.1088/1748-6041/5/1/015007.
50. S. Negi, R. Bhandari, R. Van Wagenen, and F. Solzbacher, “Factors affecting degradation of sputtered iridium oxide used for neuroprosthetic applications,” Proc. IEEE Int. Conf. Micro Electro Mech. Syst., no. c, pp. 568–571, 2010, doi:10.1109/MEMSYS.2010.5442438.
51. A. Ghazavi and S. F. Cogan, “Ultramicro-sized sputtered iridium oxide electrodes in buffered saline: Behavior, stability, and the effect of the perimeter to area ratio on their electrochemical properties,” Electrochim. Acta, vol. 423, p. 140514, Aug. 2022, doi:10.1016/J.ELECTACTA.2022.140514.
52. T. Sun et al., “Flexible IrOx neural electrode for mouse vagus nerve stimulation,” Acta Biomater., vol. 159, pp. 394–409, Mar. 2023, doi:10.1016/J.ACTBIO.2023.01.026.
53. S. F. Cogan, “Neural Stimulation and Recording Electrodes,” Annu. Rev. Biomed. Eng., vol. 10, no. 1, pp. 275–309, 2008, doi:10.1146/annurev.bioeng.10.061807.160518.
54. P. J. Gilgunn, X. C. Ong, S. N. Flesher, A. B. Schwartz, and R. A. Gaunt, “Structural analysis of explanted microelectrode arrays,” Int. IEEE/EMBS Conf. Neural Eng. NER, pp. 719–722, 2013, doi:10.1109/NER.2013.6696035.
55. K. Woeppel et al., "Explan t Analysis of Utah Electrode Arrays implanted in Human Cortex for Brain-Computer-Interfaces," _Front. Bioeng. Biotechnol._, vol. 9, p. 1137, Dec. 2021, doi: 10.3389/FBIOE.2021.759711/BIBTEX.
56. P. Takmakov, K. Ruda, K. Scott Phillips, I. S. Isayeva, V. Krauthamer, and C. G. Welle, "Rapid evaluation of the durability of cortical neural implants using accelerated aging with reactive oxygen species," _J. Neural Eng._, vol. 12, no. 2, Apr. 2015, doi: 10.1088/1741-2560/12/2/026003.
57. M. G. Street, C. G. Welle, and P. A. Takmakov, "Automated reactive accelerated aging for rapid in vitro evaluation of neural implant performance," _Rev. Sci. Instrum._, vol. 89, no. 9, Sep. 2018, doi: 10.1063/1.5024686.
58. A. Prasad et al., "Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants," _J. Neural Eng._, vol. 9, no. 5, Oct. 2012, doi: 10.1088/1741-2560/9/5/056015.
59. A. Prasad and J. C. Sanchez, "Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing," _J. Neural Eng._, vol. 9, no. 2, Apr. 2012, doi: 10.1088/1741-2560/9/2/026028.
60. C. Bennett, M. Samikkannu, F. Mohammed, W. D. Dietrich, S. M. Rajguru, and A. Prasad, "Blood brain barrier (BBB)-disruption in intracortical silicon microelectrode implants," _Biomaterials_, vol. 164, pp. 1-10, May 2018, doi: 10.1016/j.biomaterials.2018.02.036.
61. C. Bennett et al., "Neuroinflammation, oxidative stress, and blood-brain barrier (BBB) disruption in acute Utah electrode array implants and the effect of deferoxamine as an iron chelator on acute foreign body response," _Biomaterials_, vol. 188, pp. 144-159, Jan. 2019, doi: 10.1016/J.BIOMATERIALS.2018.09.040.
62. S. Negi, R. Bhandari, L. Rieth, and F. Solzbacher, "In vitro comparison of sputtered iridium oxide and platinum-coated neural implantable microelectrode arrays," _Biomed. Mater._, vol. 5, no. 1, p. 15007, 2010, doi: 10.1088/1748-6041/5/1/015007.
63. T. Aflalo et al., "Neurophysiology. Decoding motor imagery from the posterior parietal cortex of a tetraplegic human.," _Science_, vol. 348, no. 6237, pp. 906-10, May 2015, doi: 10.1126/science.aaa5417.
64. T. Aflalo, C. Zhang, B. Revechkis, E. Rosario, N. Pouratian, and R. A. Andersen, "Implicit mechanisms of intention," _Curr. Biol._, vol. 32, no. 9, pp. 2051-2060.e6, May 2022, doi: 10.1016/J.CUB.2022.03.047.
65. A. T. Gardner, H. J. Strathman, D. J. Warren, and R. M. Walker, "Impedance and noise characterizations of Utah and microwave electrode arrays," _IEEE J. Electromagn. RF Microwaves Med. Biol._, vol. 2, no. 4, pp. 234-241, Dec. 2018, doi: 10.1109/JERM.2018.2862417.
66. T. Chai and R. R. Draxler, "Root mean square error (RMSE) or mean absolute error (MAE)?-Arguments against avoiding RMSE in the literature," _Geosci. Model Dev_, vol. 7, pp. 1247-1250, 2014, doi: 10.5194/gmd-7-1247-2014.
67. P. A. P. Moran, "Notes on Continuous Stochastic Phenomena," _Biometrika_, vol. 37, no. 1/2, p. 17, Jun. 1950, doi: 10.2307/2332142.
68. S. F. Cogan, "Neural Stimulation and Recording Electrodes," _Annu. Rev. Biomed. Eng._, vol. 10, no. 1, pp. 275–309, Aug. 2008, doi: 10.1146/annurev.bioeng.10.061807.160518.
69. A. T. Rajan et al., "The effects of chronic intracortical microstimulation on neural tissue and fine motor behavior," _J. Neural Eng._, vol. 12, no. 6, p. 66018, 2015, doi: 10.1088/1741-2560/12/6/066018.
70. K. A. Sillay et al., "Long-Term Measurement of Impedance in Chronically Implanted Depth and Subdural Electrodes During Responsive Neurostimulation in Humans," _Brain Stimul._, vol. 6, no. 5, pp. 718–726, Sep. 2013, doi: 10.1016/J.BRS.2013.02.001.
71. S. A. Jones, S.-H. Shim, J. He, and X. Zhuang, "Fast, three-dimensional super-resolution imaging of live cells," _Nat. Methods_, vol. 8, no. 6, pp. 499–505, 2011, doi: 10.1038/nmeth.1605.
72. V. Thakore, P. Molnar, and J. J. Hickman, "An optimization-based study of equivalent circuit models for representing recordings at the neuron-electrode interface," _IEEE Trans. Biomed. Eng._, vol. 59, no. 8, pp. 2338–2347, 2012, doi: 10.1109/TBME.2012.2203820.
73. N. Lago et al., "A physical-based equivalent circuit model for an organic/electrolyte interface," _Org. Electron._, vol. 35, pp. 176–185, Aug. 2016, doi: 10.1016/J.ORGEL.2016.05.018.
74. J. Jiang, F. R. Willett, and D. M. Taylor, "Relationship between microelectrode array impedance and chronic recording quality of single units and local field potentials," _2014 36th Annu. Int. Conf. IEEE Eng. Med. Biol. Soc. EMBC 2014_, pp. 3045–3048, Nov. 2014, doi: 10.1109/EMBC.2014.6944265.
75. P. A. Cody, J. R. Eles, C. F. Lagenaur, T. D. Y. Kozai, and X. T. Cui, "Unique electrophysiological and impedance signatures between encapsulation types: An analysis of biological Utah array failure and benefit of a biomimetic coating in a rat model," _Biomaterials_, vol. 161, pp. 117–128, Apr. 2018, doi: 10.1016/J.BIOMATERIALS.2018.01.025.
76. S. W. . Freiman and J. J. . Mecholsky, _The Fracture of Brittle Materials: Testing and Analysis_. John Wiley & Sons, Inc., 2012. doi: 10.1002/9781118147757.
77. E. Ilic, A. Pardo, R. Hauert, P. Schmutz, and S. Mischler, "Silicon Corrosion in Neutral Media: The Influence of Confined Geometries and Crevice Corrosion in Simulated Physiological Solutions," _J. Electrochem. Soc._, vol. 166, no. 6, pp. C125–C133, Mar. 2019, doi: 10.1149/2.0241906iES/XML.
78. S. R. Kane, S. F. Cogan, J. Ehrlich, T. D. Plante, D. B. McCreery, and P. R. Troyk, "Electrical performance of penetrating microelectrodes chronically implanted in cat cortex," _IEEE Trans. Biomed. Eng._, vol. 60, no. 8, pp. 2153–2160, 2013, doi: 10.1109/TBME.2013.2248152.
79. P. A. House, J. D. MacDonald, P. A. Tresco, and R. A. Normann, "Acute microelectrode array implantation into human neocortex: preliminary technique and histological considerations," _Neurosurg. Focus_, vol. 20, no. 5, 2006, doi: 10.3171/FOC.2006.20.5.5.
80. B. P. Christie, K. R. Ashmont, P. A. House, and B. Greger, "Approaches to a cortical vision prosthesis: implications of electrode size and placement," _J. Neural Eng._, vol. 13, no. 2, Feb. 2016, doi: 10.1088/1741-2560/13/2/025003.
补充材料
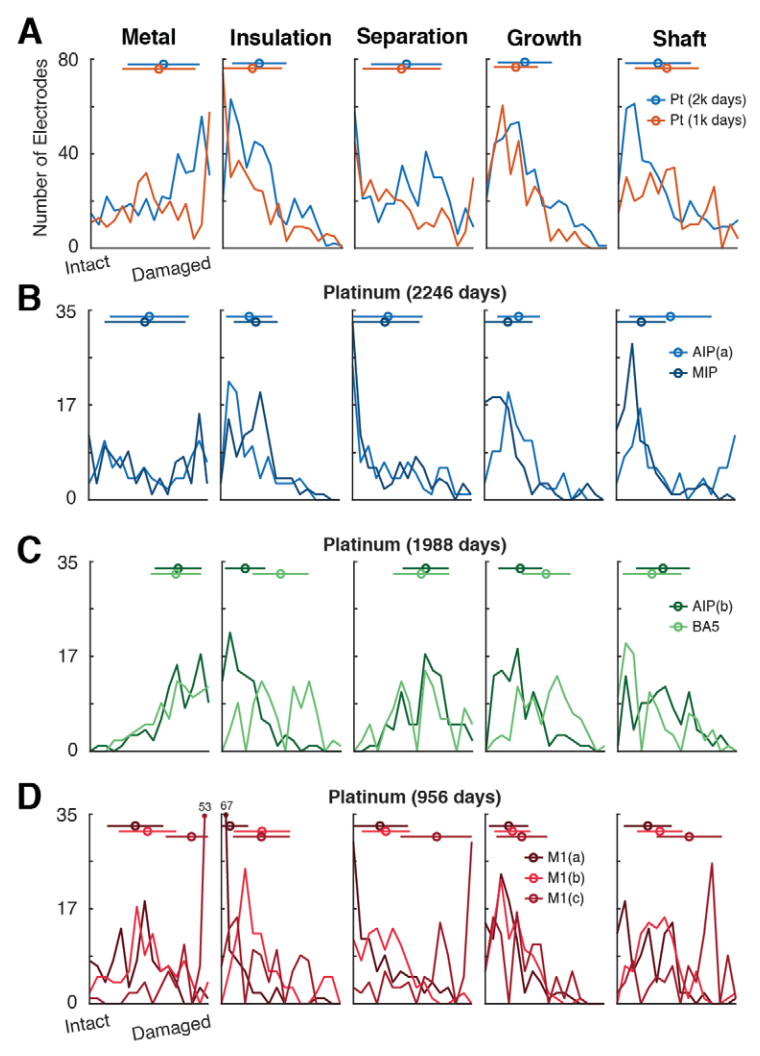
图 S1 | 退化指标详细直方图(铂)
图4A中视觉评估退化指标的详细直方图,按每个单独的阵列和参与者分开。均值和标准差显示为上方的一条线和一个圆圈;然而,许多直方图似乎是双峰或指数分布。Y轴显示电极数量,X轴显示损伤程度(1,完整 – 4,严重损伤)。(A) 所有植入~2000天的Pt电极(蓝色)与~1000天(红色)的汇总直方图。~2000天的电极总数为389,~1000天的总数为393。(B-C) 来自两位Caltech参与者的阵列。(D) 来自一位JHU参与者的Pt阵列。
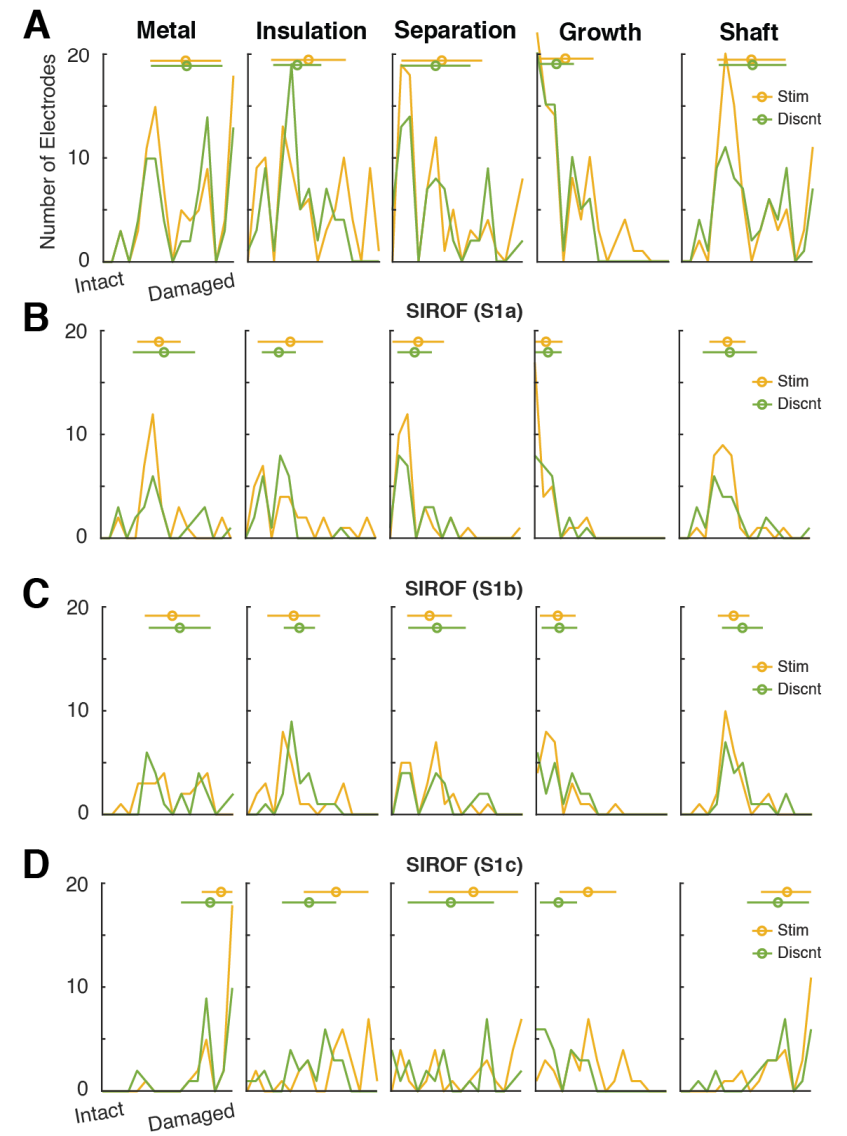
图 S2 | 退化指标详细直方图(SIROF)
图4B中视觉评估退化指标的详细直方图,按每个单独的阵列分开(均来自JHU参与者)。Y轴显示电极数量,X轴显示损伤程度(1,完整 – 4,严重损伤)。(A) 所有受刺激SIROF电极(黄色)与未连接电极(绿色)的汇总直方图。电极的空间组织见图1F,G。(B-D) 来自对侧半球的阵列。(D) 来自同侧半球的一个阵列。

图 S3 | 失效机制示例,SEM图像
我们观察到多种电极金属化失效模式。以下是一些电极尖端金属处于不同退化状态的示例。
(A-C) 这些电极在金属化SEM评估指标中被评为1(完整)。它们表现出完美或近乎完美的尖端金属。允许存在微小的孔洞(图B插图)或细线裂纹(图C)。
(D-F) 这些电极被评为2(轻微损伤),金属损失量大于10%。在图F中,金属已开始从硅针杆上剥落。
(G-I) 这些电极被评为3(损伤),尖端金属损失量大于50%。金属下方的硅已被蚀刻掉,减少了表面积并导致硅与尖端金属之间的分离。
(J-L) 这些电极被评为4(严重损伤)。金属损失超过90%。在图K,L中,硅也完全被侵蚀,没有留下支撑或表面积供尖端金属附着。

图 S4 | 各阵列的SEM图像
每个阵列都通过SEM成像捕获。(A) AIP(b)。(B) MIP。(C) AIP(a)。(D) BA5。(E) 对照。(F) M1(a)。(G) M1(b)。(H) M1(c)。(I) S1(a)。(J) S1(b)。(K) S1(c)。
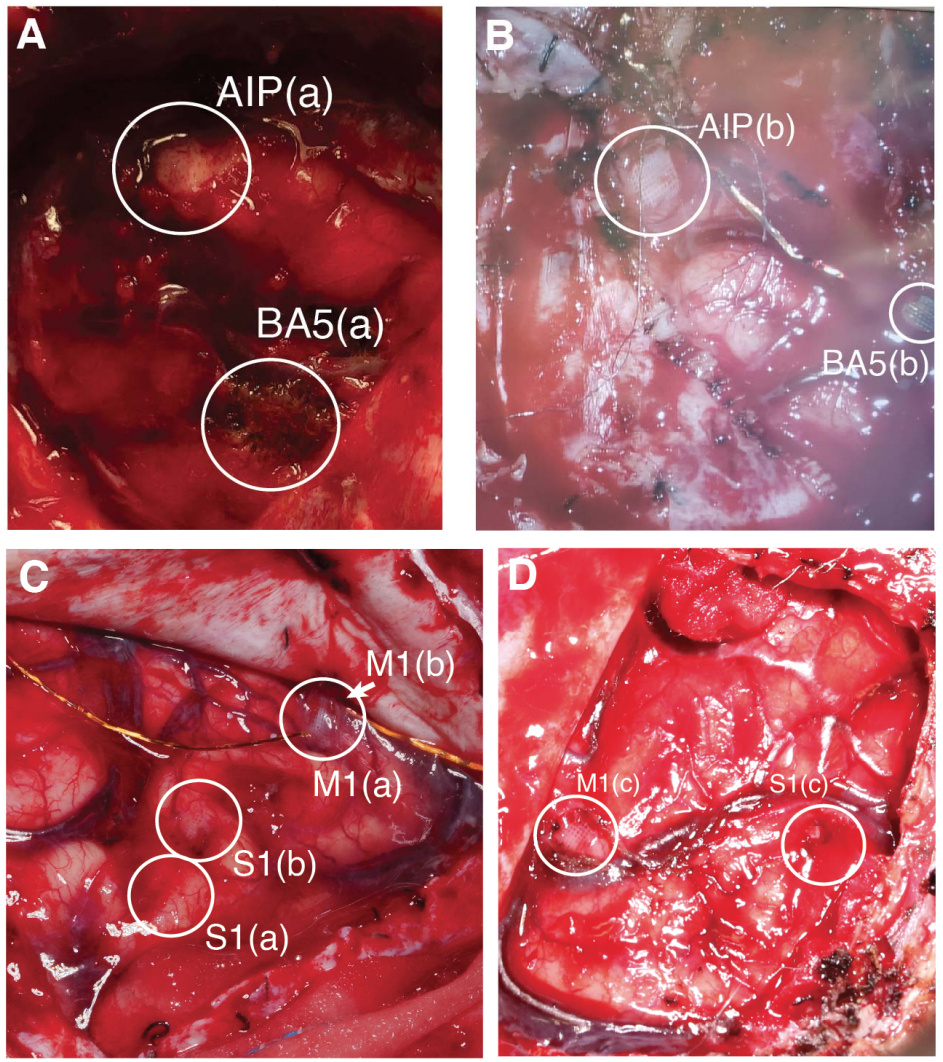
图 S5 | 取出后的皮层
取出过程中的一些图像显示,阵列被抬起后,皮层组织中留下了清晰的针杆压痕。(A) Caltech/UCLA (B) Caltech/USC (C) APL/JHU 对侧半球。(D) APL/JHU 同侧半球。

文献链接:https://www.medrxiv.org/content/10.1101/2024.09.09.24313281v1.full#F4
文献 DOI:https://doi.org/10.1101/2024.09.09.24313281
脑机接口产业联盟作为脑机接口的合作与促进平台,着力聚集产业界各方资源,共同致力于推进脑机接口产业发展、需求与架构、标准、产品、解决方案及应用推广,形成良好的合作氛围及协作机制,围绕产业链,协调组织关键问题研究和核心技术攻关,促进产业生态繁荣,为中国及全球脑机接口产业发展提供必要支撑。
加入方式
关注脑机接口产业联盟公众号,菜单栏获取联盟加入申请表格,材料齐全后发秘书处。
欢迎业界积极参与联络,联系邮箱:bcia@caict.ac.cn。

(扫码获取加入联盟的申请材料)

 扫码添加微信
扫码添加微信
- 点赞 (0)
-
分享
微信扫一扫
-
加入群聊
 扫码加入群聊
扫码加入群聊









